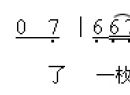《盐类的水解》第一课时 教学设计(2)
NH4++ OH- NH3?H2OH2O H++OH-
CH3COO- + H+ CH3COOH
[讲]请同学们讨论一下第一个问题,为什么CH3COONa水溶液呈碱性呢?醋酸钠、氯化钠都是盐,是强电解质,他们溶于水完全电离成离子,电离出的离子中既没有氢离子,也没有氢氧根离子,而纯水中[H+]=[OH-],显中性。而实际上醋酸钠显碱性,即[H+]<[OH-],氯化铵溶液显酸性,即[H+]>[OH-]
[板书]二、盐溶液呈现不同酸碱性的原因
[讲]CH3COONa溶于水之后,完全电离。(因为CH3COONa是强电解质。)
[投影]CH3COONa ═ CH3COO- + Na+……⑴
[问]把CH3COONa溶于水之后,溶液中存在哪些电离平衡?
[投影] H2O H+ + OH-……⑵
[讲]我们知道,CH3COOH是一种弱酸,在溶液中部分电离,溶液中既然存在CH3COO-和H+,根据,可逆反应,反应物和生成物同时共存,那么就一定有CH3COOH。
[投影]CH3COO- + H+ CH3COOH……⑶
[讲]把⑴⑵⑶式联立,可得到
[投影]水解方程式:CH3COONa + H2O CH3COOH + NaOH
[讲]这说明CH3COONa溶于水后,反应有NaOH生成,所以溶液显碱性。把上述化学方程式改写成离子方程式。
[投影]CH3COO- + H2O CH3COOH + OH-
[讲]随着CH3COONa的加入,对水的电离有什么影响呢?促进了水的电离,可以看作是使水分解了。醋酸钠与水反应的实质是:醋酸钠电离出的醋酸根离子和水电离出的氢离子结合生成弱电解质醋酸的过程。
[投影]1、弱酸强碱盐,水解显碱性
CH3COONa = CH3COO? + Na+
+
H2O H+ + OH?
??
CH3COOH
CH3COONa + H2O CH3COOH + NaOH